سرامیک های اکسیدی (Pure oxide ceramics) شامل آلومینا، زیرکونیا، توریا، برلیا، منیزیا، سیلیکا، تیتانیا، اسپینلهای اکسیدی و … است.
تقسیم بندی سرامیک های مهندسی
سرامیک های مهندسی به دو گروه اصلی تقسیم می شوند:
- سرامیک های اکسیدی (Pure oxide ceramics)
- سرامیک های غیر اکسیدی (Non-oxidized ceramics)
سرامیک های اکسیدی (Pure oxide ceramics)
برخی از پرکاربردترین سرامیک های اکسیدی عبارتاند از:
- آلومینا (Al۲O۳) (alumina)
- زیرکونیا (ZrO۲) (zirconia)
- توریا (Th0۲) (thoria)
- برلیا (BeO) (beryllia)
- منیزیا (MgO) (magnesia)
- سیلیکا (SiO۲) (silica)
- تیتانیا (TiO۲) (titania)
- اسپینل (MgAl۲۰۴) (spinel)
- (Mg۲Si0۴) (forsterite)
معرفی برخی از سرامیک های اکسیدی
آلومینا یا آلومینیوم اکسید Alumina ( از خانواده سرامیک های اکسیدی )
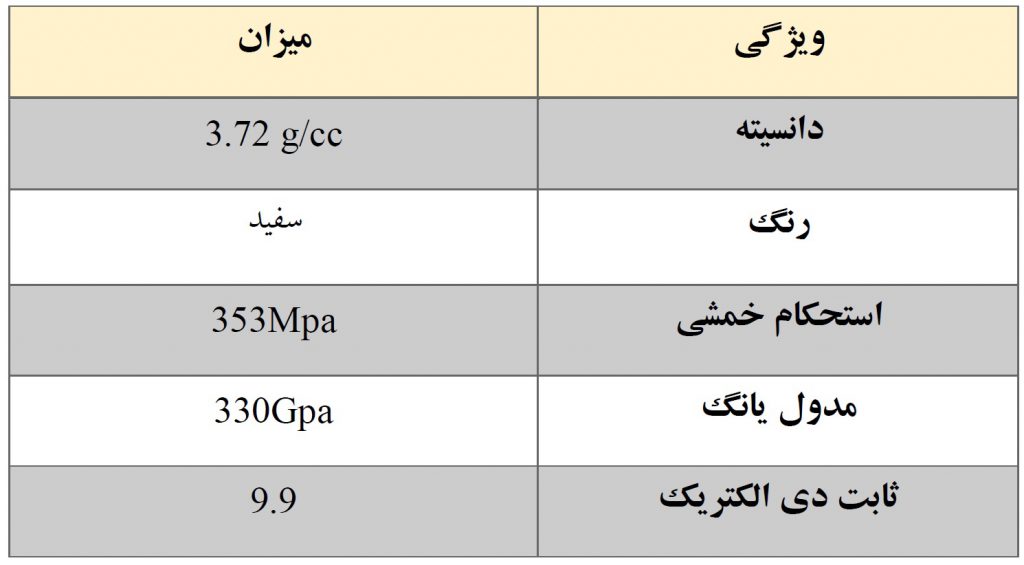
آلومینا یا اکسید آلومینیوم Al۲O۳ Alumina یک عایق الکتریکی عالی و یکی از پرکاربردترین سرامیک های اکسیدی یا مواد سرامیکی پیشرفته است. آلومینا ترکیبی از خواص مکانیکی الکتریکی عالی را ارائه می دهد که منجر به طیف گسترده ای از کاربردهای صنعتی و آزمایشگاهی می شود.
خواص آلومینا
آلومینا همچنین به عنوان آلومینیوم اکسید یا اکسید آلومینیوم معروف است که از آلومینیوم و اکسیژن تشکیل شده است. آلومینا از نظر ظاهری جامد سفید مانند نمک خوراکی است. آلومینا دارای دمای جوش ۲۹۸۰ درجه سانتیگراد و نقطه ذوب ۲۰۴۰ درجه سانتیگراد است.
شکل ۱: پودر آلومینا.
از جمله ویژگی های منحصر به فرد آلومینا می توان به موارد زیر اشاره کرد:
• سختی بسیار بالا
• مقاومت سایشی مناسب
•خواص دی الکتریک عالی
• مقاومت شیمییایی بالا در دماهای بالا
•هدایت حرارتی مناسب
آلومینا دارای پیوندهای کریستالی بسیار قوی است که موجب ویژگی های منحصر به فرد آن می شود. اکسید آلومینیوم در چندین حالت کریستالی مختلف وجود دارد که تمامی انواع آن در دماهای بالا به پایدارترین حالت یعنی فاز آلفا هگزاگونال باز می گردند.
شکل ۲: ساختار کریستالی آلومینا.
آلومینا فاز آلفا مستحکم و سخت ترین سرامیک اکسیدی است. سختی بالای آن ، خواص عالی دی الکتریک ، مقاومت در برابر شوک و خاصیت حرارتی مناسب، آن را به عنوان ماده انتخابی برای طیف گسترده ای از کاربردها ها تبدیل کرده است.
آلومینا با خلوص بالا تا ۱۹۲۵ درجه سانتیگراد مقاومت به اکسیداسیون بسیار مناسبی از خود نشان می دهد. در برابر همه گازها بجز فلوئور مرطوب مقاومت شیمیایی بالایی دارد و همچنین در برابر همه مواد اسیدی به جز اسید هیدروفلوئوریک و اسید فسفریک مقاوم است. کنش های شیمیایی معمولا در دماهای بالا ، در حضور بخارات قلیایی، به ویژه در خلوص پایین رخ می دهد.
در جدول زیر دیگر مشخصه های ماده سرامیکی آلومینا آورده شده است:
فرآیند ساخت آلومینا
آلومینا عناصر اصلی سنگ معدنی بوکسیت است ، بنابراین بوکسیت به منظور تولید آلومینا تصفیه می شود. فرآیند بایر روش اصلی تولید آلومینا با تصفیه سنگ بوکسیت است. بوکسیت به غیر از ۳۰-۶۰ درصد اکسید آلومینیوم حاوی مخلوطی از سیلیس ، اکسید آهن و دی اکسید تیتانیوم است.
شکل ۳: سنگ معدنی بوکسیت.
بوکسیت قبل از فرآیند بایر خرد شده و در آسیاب به ذرات ریز خرد می شود (حداکثر اندازه ۰.۰۶ / ۱/۱ میلی متر).
سپس محلول هیدروکسید سدیم به آن اضافه می شود که یک دوغاب بوکسیت تشکیل شود، که در مخازن نگهدارنده ذخیره می شوند.
اکسید آلومینیوم تصفیه شده با استفاده از فرآیند بایر شامل چهار مرحله از دوغاب بوکسیت بدست می آید:
۱-خردایش
۲-جداسازی ناخالصی و فیلتراسیون
۳- رسوب دهی
۴- کلسینه
• خردایش
در این مرحله ، دوغاب بوکسیت از مخازن نگهدارنده به اتوکلاوها پمپ می شود که در آن محلول هیدروکسید سدیم در دمای حدود ۱۵۰-۲۰۰ درجه سانتیگراد گرم می شود.
درجه حرارت و فشار بستگی به ترکیب کانی شناسی بوکسیت دارد. بیشتر سنگ معدن های بوکسیت از گیبسیت (Al (OH) 3)، بوهمیت (AlOOH) و دیاسپور (α-AlO (OH))تشکیل شده است.
در ای مرحله واکنش های زیر اتفاق می افتد:
AlO(OH)*H۲O + 2NaOH = ۲NaAlO۲ + 4H۲O
AlO(OH) + 2NaOH = 2NaAlO۲ + ۲H۲O
AlO(OH) + 2NaOH = 2NaAlO۲ + ۲H۲O
• جداسازی ناخالصی و فیلتراسیون
در این مرحله مخلوط برای حذف ناخالصی ها تصفیه می شود. به غیر از آلومینا و سیلیس ، سایر اجزای موجود در بوکسیت حل نمی شوند. مواد جامد که حل نمی شوند در پایین تشکیل گل قرمز می دهند. سپس این گل قرمز با استفاده از تله ماسه ای چرخان از محلول جدا می شود.
فرایند فیلتراسیون اکسید آلومینیوم را به آلومینات سدیم ، ۲NaAlO۲ ، مطابق با معادله تبدیل می کند:
Al۲O۳ + ۲NaOH → ۲NaAlO۲ + H۲O.
• رسوب دهی
بلورهای هیدروکسید آلومینیوم در این مرحله بازیابی می شوند. محلول هیدروکسیدی از طریق مبدلهای حرارتی به رسوب دهنده ها (مخازن ضخیم کننده) پمپ می شوند ، که گرمای حاصل از محلول رامنتقل می کنند.
رسوب هیدروکسید آلومینیوم با جوانه زنی و رشد با کریستالهای آلومینای خالص که به عنوان هسته برای فرآیند رسوب دهی عمل می کنند ترویج می شود.
کریستالهای هیدروکسید آلومینیوم / آلومینا تری هیدرات (Al۲O۳ . ۳H۲O) رشد کرده و جمع می شوند. ذرات درشت از ذرات ریز جدا شده و در نهایت منتقل می شوند و همچنین ذرات ریز از دوغاب فیلتر شده و بعنوان بلورهای جوانه زا بکار می روند.
• کلسینه
بلورهای آلومینیومی هیدرات شسته شده ، خشک می شوند و سپس با دمای ۱۸۵۰-۲۳۰۰ درجه سانتی گراد در یک کوره چرخشی یا یک بستر سیال اعمال حرارت صورت می گیرد:
Al۲O۳ * ۳H۲O = Al۲O۳ + ۳H۲O
یا
Al (OH) ۳ = ۲Al۲O۳ + ۳H۲O۲
در دمای ۷۵۰-۱۱۱۰ درجه سانتی گراد γ-Al2O3 تشکیل می شود. در دماهای بالاتر از ۱۱۵۰ درجه سانتیگراد گاما آلومینا به آلفا آلومینا (کوروندوم) تبدیل می شود که از نظر شیمیایی خنثی است.
محصول نهایی یک پودر آلفا آلومینا بی آب و سفید خشک با ذرات۰.۵-۱۰μm است.
ناخالصی اصلی آلومینای کلسینه حاصل از فرآیند بایر اکسید سدیم است که ممکن است غلظتی بین ۳۰۰ تا ۷۰۰۰ ppm داشته باشد.
کاربرد آلومینا
می توان ادعا کرد که آلومینا یکی از مقرون به صرفه ترین مواد سرامیکی است و در نتیجه یکی از پر کاربردترین ها است. ترکیب آن از هدایت حرارتی بالا و انبساط حرارتی کم ، مقاومت خوب در برابر شوک حرارتی برخوردار است.
برخی از کاربردهای رایج آلومینا در ادامه مورد بررسی قرار گرفته است:
ساینده های صنعتی
صنایع نسوز
صنعت شیشه
سرامیک های مهندسی
• ساینده های صنعتی
آلومینا به دلیل سختی و استحکام عالی ، در انواع مواد ساینده صنعتی بسیار مورد استفاده قرار می گیرد. به همین ترتیب، آلومینا می تواند به عنوان پوششی برای محافظت در برابر سایش استفاده شود.
شکل ۴: چرخ های ساینده آلومینایی.
• صنایع نسوز
آلومینا همچنین به دلیل داشتن نقطه ذوب زیاد در محصولات نسوز نیز بسیار مورد استفاده قرار می گیرد. این به خصوص برای کاربردهایی مناسب است که در آن باید مقاومت نسوز در دماهای بالا حفظ شود.
• صنعت شیشه
آلومینا اغلب در تولید محصولات شیشه ای مورد استفاده قرار می گیرد و به عنوان تقویت کننده موجب افزایش استحکام می شود.
• سرامیک های مهندسی
آلومینا همچنین در سرامیک های مهندسی بسیار مورد استفاده قرار می گیرد ، همچنین به آن سرامیک پیشرفته یا فنی نیز می گویند. این مواد سرامیکی مهندسی شده برای کاربردهای مخصوصاً خشن که نیاز به افزایش مقاومت در برابر سایش ، پایداری حرارتی و شیمیایی دارند ، ساخته شده اند و بسیاری از خصوصیات دیگر آلومینا را در اختیار دارد. سرامیک های مهندسی کاربردهایی در صنایع از مواد شیمیایی و پزشکی ، صنعتی ، الکتریکی و… دارند.
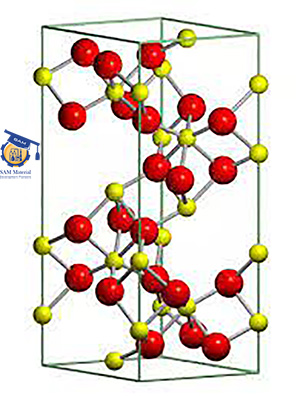
زیرکونیا ( از خانواده سرامیک های اکسیدی )
زیرکونیا ZrO۲ (zirconia) همچنین به عنوان دی اکسید زیرکونیم نیز شناخته می شود ، یک اکسید فلزی کریستالین است که راه خود را به صنعت سرامیک پیدا کرده است.از مشخصه های این ماده می توان به مواردی از جمله مقاومت حرارتی بالا ، مقاومت مکانیکی و سایشی بالا اشاره کرد..
برای اولین بار در سال ۱۹۶۹ در صنایع پزشکی مورد استفاده قرار گرفت ، زیرکونیا زیست سازگاری بسیار مناسب، خواص تریبولوژی عالی و خواص مکانیکی بالایی دارد. از متداول ترین سیستم های زیرکونیا، حالت مکعبی آن است. یک ترکیب بلوری با ساختمان مکعبی، بی رنگ و از نظر مکانیکی سخت است. به دلیل خاصیت نوری بی عیب و نقص ، به عنوان یک جایگزین کم هزینه برای الماس ها در صنعت جواهرات کاربرد دارد. زیرکونیا را نباید با زیرکون (یا سیلیکات زیرکونیوم) اشتباه گرفت ، زیرکونیا یک ماده معدنی است که در صنعت سرامیک و مواد نسوز نیز مورد استفاده قرار می گیرد[۱].
شکل ۱: استفاده از زیرکونیا در صنایع پزشکی.
خواص زیرکونیا
زیرکونیا یک جامد کریستالی است که از لحاظ رنگی سفید است ، اما می تواند در رنگ های مختلفی تولید شود. به طور طبیعی ، از ماده معدنی بادلیت به دست می آید. بادلیت، یک ماده معدنی نادر که دارای یک ساختار بلوری منوکلینیک است. زیرکونیا همچنین به عنوان “فولاد سرامیکی” شناخته می شود ، از نظر شیمیایی خنثی است و به دلیل خواص مکانیکی عالی ، یکی از مواد ترمیم کننده بسیار خوب محسوب میشود.
شکل ۲: سنگ معدن بادلیت.
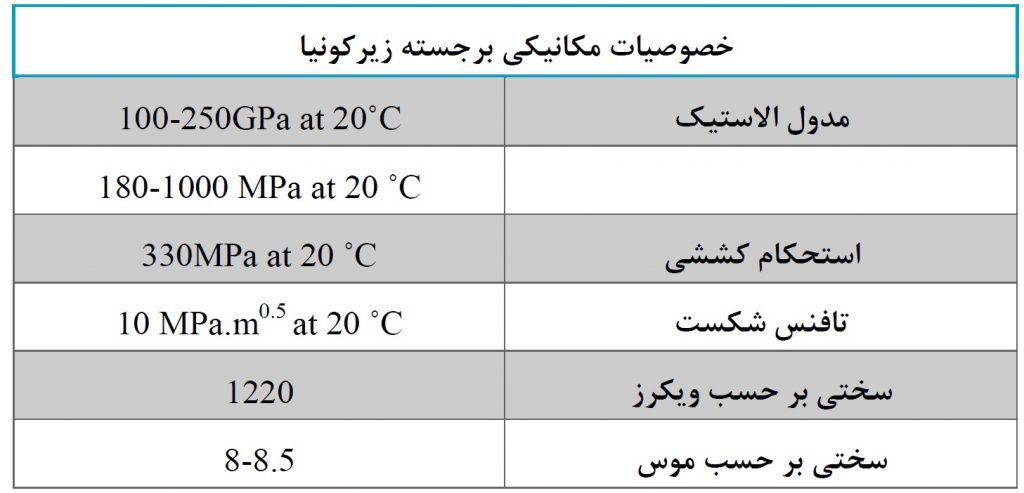
از بین تمام مواد سرامیکی پیشرفته ، زیرکونیا بالاترین مقاومت و استحکام را در دمای اتاق دارد. در دماهای بالا، زیرکونیا ممکن است در طول تحول فاز تغییر حجم قابل توجهی داشته باشد. در نتیجه ، بدست آوردن محصولات پایدار زیرکونیا در حین پخت دشوار است ، به همین دلیل به طور کلی تثبیت زیرکونیا مورد نیاز است. زیرکونیا تثبیت شده (PSZ) از خواص مکانیکی استثنایی و پایداری شیمیایی عالی ، حتی در محیط های شدید نیز بهره می برد. به دلیل داشتن خواص مکانیکی برتر ، به عنوان جایگزین آلومینا در کاربردهای پزشکی مانند ایمپلنت های دندانی مورد استفاده قرار می گیرد و از نظر مقاومت مکانیکی با دندانها قابل مقایسه است [۲].
از جمله خواص فوق العاده زیرکونیا می توان به مواردی از جمله چقرمگی ، زیست سازگاری ، مقاومت خستگی و سایش بالا اشاره کرد؛ که این خواص منحصر به فرد آن را برای کاربردهای دندانی مناسب می کند. به طور خاص زیرکونیوم (Zr) در واقع یکی از دو فلز رایج در ایمپلنت های دندانی است ، در کنار تیتانیوم ، زیرا هر دو خاصیت فیزیکی و شیمیایی بسیار خوبی از خود نشان می دهند و اجازه رشد استئوبلاست ها را می دهند که در واقع سلول هایی هستند که استخوان ها را تشکیل می دهند. در اینجا لیستی از برجسته ترین خصوصیات فیزیکی و شیمیایی زیرکونیا آورده شده است. این خواص به اندازه کافی بالا هستند که اجازه می دهد زیرکونیا به عنوان یک ماده مؤثر برای بسیاری از کاربردها ، خصوصاً برای کاربردهای نسوز و دندانپزشکی، مؤثر باشد[۳].
•مقاومت مکانیکی بالا
زیرکونیا در برابر ترک خوردگی (توسعه و رشد بیشتر ترک) و تنش مکانیکی بسیار مقاوم است. سایر خصوصیات مکانیکی برجسته زیرکونیا در جدول زیر نشان داده شده است.
مقاومت در برابر دمای بالا
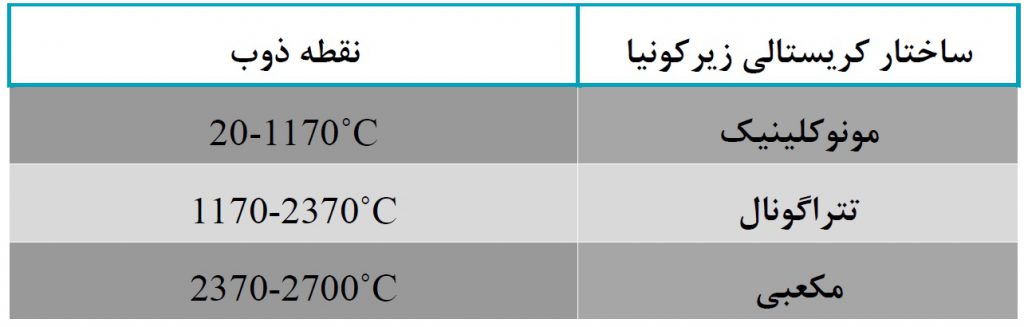
با وجود دمای ذوب ۲۷۰۰ درجه سانتیگراد و ضریب انبساط حرارتی۱.۰۸×۱۰-۵ K-۱ ، زیرکونیا به دلیل مقاومت بالای آن در برابر گرما بسیار معروف است. به همین دلیل است که این مجموعه در صنایع نسوز و صنایع با درجه حرارت بالا کاربردهای زیادی دارد. در اینجا دامنه های مختلف دمای نقطه ذوب زیرکونیا ، بر اساس اشکال وابستگی آن به دما ، ارائه شده است.
با این حال ، پس از گرم شدن ، زیرکونیا ممکن است دستخوش تغییر فاز شود، به ویژه در فرم تتراگونال آن، جایی که فشارهای داخلی ایجاد می شود، و ترک ها شروع به گسترش می کنند. به منظورحل این مشکل، تثبیت کننده هایی مانند ایتریا افزوده می شود.
•رسانایی حرارتی کم
زیرکونیا دارای هدایت حرارتی 2 W / (m · K) است ، که باعث می شود در شرایطی که گرما و حرارت نیاز به مهار دارد ، کاملا قابل استفاده باشد.
•مقاومت شیمیایی
این ماده از نظر شیمیایی خنثی و غیرفعال است. در صنایعی کاربرد دارد که در طی فرآوری از چندین ماده شیمیایی استفاده می کنند. با این حال ، این ترکیب در اسیدهای غلیظ مانند اسید سولفوریک یا هیدروفلوئوریک حل می شود.
تولید و فرآوری زیرکونیا
تولید زیرکونیا وابسته به دما ممکن است منجر به سه ساختار کریستالی شود: مونوکلینیک ، تتراگونال و مکعب. این خاصیت منحصر به فرد دی اکسید زیرکونیوم باعث انعطاف پذیری استفاده در طیف گسترده ای از کاربردها و صنایع می شود.
زیرکونیا از طریق عملیات حرارتی تولید می شود، اگرچه انجام این کار به شکل خالص آن ممکن است باعث ایجاد تغییر فاز ناگهانی شود که می تواند منجر به شکست شود. بدین منظور از دوپ کردن تثبیت کننده هایی مانند اکسید منیزیم ، اکسید ایتریم و اکسید کلسیم ، برای حفظ ساختار استفاده می شود. این عملیات حرارتی همچنین تحت عنوان کلسیناسیون از آن نام برده می شود ، جایی که اعمال حرارت در دمای بالا و در یک محیط اکسیژنی یا هوا انجام می شود.
زیرکونیا همچنین می تواند با تجزیه ماسه زیرکون از طریق ترکیب با ترکیباتی مانند کربنات کلسیم، اکسید کلسیم، کربنات سدیم، اکسید منیزیم و هیدروکسید سدیم به دست آید.
کاربردهای زیرکونیا
خواص مکانیکی بالا زیرکونیا ، پایداری شیمایی بالا ، پایداری در دمای بالا ، مقاومت در برابر خوردگی و کیفیت بالای این فولاد سرامیکی را در بسیاری از صنایع جزو گزینه های مناسب و کاربردی قرار داده است. بسیاری از محصولات امروزی اعم از مواد نسوز تا محصولات پزشکی ، رنگدانه ها ، الکترونیک ، روکش ها و سرامیک ها به دلیل ویژگی های برتر و مزایای آن در مقایسه با سایر مواد ، زیرکونیا مرجح بوده است. برخی از کاربردهای معمولی زیرکونیا شامل قالب های داغ برای اکستروژن فلز داغ ، سنسورهای اکسیژن ، غشاهای موجود در سلول های سوختی ، صندلی های سوپاپ های عمقی و دریچه های پمپ دریایی است. در اینجا لیستی از رایج ترین کاربردهای زیرکونیا آورده شده است.
•سرامیک
استحکام مکانیکی و مقاومت زیرکونیا آن را به اجزای مناسبی برای ساخت سرامیک تبدیل می کند. شکل۳ چاقوهای سرامیکی را نشان می دهد که به دلیل ضریب سختی زیاد زیرکونیا به طور قابل توجهی سخت تر از کارد و چنگال های لبه فلزی هستند.
شکل ۳: چاقوهای سرامیکی ساخته شده از زیرکونیا.
•صنایع نسوز
به دلیل مقاومت حرارتی بالا ، زیرکونیا به عنوان یکی از اجزاء در کوره ها و سایر محیط های پر حرارت استفاده میشود. علاوه بر این، دی اکسید زیرکونیوم باعث افزایش خاصیت ضد حریق سرامیک ها می شود. آجرهای نسوز و صفحات زره پوش نمونه هایی از کاربردهای نسوز مبتنی بر زیرکونیا هستند [۵]. زیرکونیا همچنین می تواند به اکسید آلومینیوم اضافه شود تا برای فرآیند ریخته گری فولاد مورد استفاده قرار گیرد.
شکل۴: آجرهای نسوز ساخته شده از زیرکونیا.
•پوشش سد حرارتی (TBC)
زیرکونیا به عنوان پوششی برای اجزای موتور جت که در معرض دمای بالا قرار دارد، اعمال می شود. این امر از طریق هدایت حرارتی کم این ترکیب و مقاومت در برابر حرارت بالا امکان پذیر است. مطالعات تأثیر دی اکسید زیرکونیوم را برای کاربردهای TBC ، زمانی که این پوشش به درستی و یکنواخت اعمال شود، تایید کرده است.
•صنعت دندانپزشکی
به دلیل زیست سازگاری ، زیبایی شناسی خوب و خواص مکانیکی بالا ، یکی از محبوب ترین کاربردهای زیرکونیا در دندانپزشکی است ، به طور عمده در ترمیم های دندانپزشکی برای پل ها ، تاج ها و روکش های چینی فلدسپار و پروتزهای دندانی کاربرد دارد. دی اکسید زیرکونیوم پایدار شده با ایتریا نیز در تولید تاج های زیرکونیا مؤثر است.
شکل ۵: تاج های دندانی ساخته شده از زیرکونیا.
•مقاوم در برابر خراش و مواد ساینده
زیرکونیا با داشتن مقاومت مکانیکی بالا و مقاومت در برابر سایش ، به عنوان ماده ساینده مورد استفاده قرار میگیرد. همچنین به دلیل مقاومت ترکیب در برابر خراش و فشار مکانیکی ، به عنوان یک لایه محافظ برای قطعات مکانیکی مفید است.
•سیستم های غنی از اکسیژن
در حالی که سایر مواد ممکن است اکسیداسیون را تجربه کرده ، اما زیرکونیا در حضور اکسیژن پایدار است. در واقع، این ماده در غشاهای سلول سوختی و مکانیزم های سنجش اکسیژن حتی در دماهای بالا استفاده می شود.
•صنعت جواهرات
زیرکونیا در حالت مکعبی، به عنوان یک جایگزین مناسب برای الماس (که بسیار گران است) تکامل یافته است. گذشته از دوام و شباهت زیبایی آن با الماس ، زیرکونیا مکعبی بر خلاف الماس برش هایی را ایجاد می کند و دارای خواص نوری بی عیب و نقص است که با چشم غیر مسلح کاملاً بی رنگ به نظر می رسد. معمولاً به عنوان یک الماس مصنوعی از آن یاد می شود، زیرا از لحاظ بصری به الماس طبیعی شباهت دارد اما از خصوصیات شیمیایی یکسانی برخوردار نیستند[۴].
شکل ۶: الماس مصنوعی، زیرکونیا مکعبی.
اسپینل ها، سرامیک های اکسیدی با خواص منحصر به فرد
اسپینل نامی است که به موادی با فرمول مشترک AB۲O۴ اطلاق می شود، که ساختار مشابهی با بسیاری از اکسیدهای فلزات انتقالی مثل MgAl۲O۴ دارد. A و B در ساختار های اسپینل می توانند کاتیون های دو یا سه ظرفیتی مثل آهن، منیزیم، آلومینیوم باشند. اسپینل ها بسته به ماهیت کاتیون ها در شبکه فرعی A و B می توانند ترکیبات مغناطیسی (Fe۳O۴) و غیر مغناطیسی MgAl۲O۴ باشند.
خواص اسپینل ها
اسپینل ها به صورت بلورهای کوچک هشت ضلعی و معمولا به صورت دو قلو شکل می گیرند. نقطه ذوب این مواد حدود ۲۱۰۰ درجه سانتی گراد می باشد. بسته به وجود ناخالصی های مختلف، طیف گسترده ای از رنگ ها و ویژگی ها برای هر یک از آ ها یافت می شوئ و همچنین می توانند شفاف یا مات باشند.
از دیگر ویژگی های متمایزکننده اسپینل ها از سنگ هایی مثل گارنت، این است که اسپینل ها در معرض گرما و حرارت هیچ گونه خاصیت الکتریکی ندارند. به دلیل ساختار کریستالوگرافی منحصر به فرد اسپینل ها، سطح ویژه و کسرحجمی اتم ها در مناطق بین سطحی، بالا است و لذا از خواصی از جمله خاصیت کاتالیزوری، سختی و پلاستیسیته بالا دارا می باشد.
انواع اسپینل ها
در دسته بندی کلی دو نوع اسپینل نرمال و معکوس وجود دارد. که هر کدام از آن ها در ادامه به اختصار توضیخ داده شده است.
• اسپینل نرمال
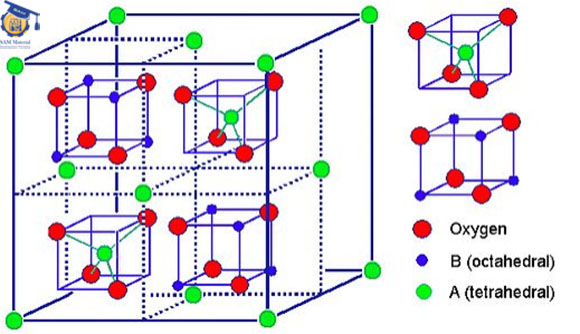
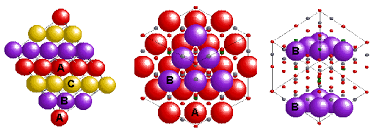
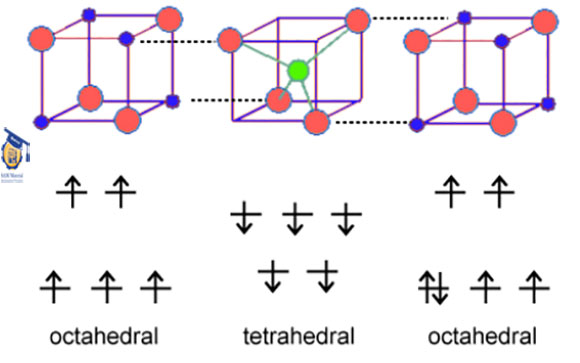
در ساختار اسپینل نرمال، آنیون ها در حالت فشرده قرار می گیرند. در واقع کاتیون های A میزان ۸/۱ از فضای تتراهدرال و کاتیون های B میزان ۲/۱ فضای اکتاهدرال را پر می کنند. به عیارت دیگر هر سلول واحد از ۸ واحد فرمولی تشکیل شده است و در مجموع به صورت A۸B۱۶O۳۲ در می آید.
شکل ۱: شماتیک ساختار کریستالی اسپینل نرمال.
• اسپینل معکوس
فرمول اسپینل های معکوس به صورت B(AB)O۴ می باشد. در واقع همه یون های A و نیمی از یون های B در یک فضای خاص قرار می گیرند و نیمی دیگر از یون های B نیز در فضای دیگری جای می گیرند. این جای گیری یون ها به صورت چرخشی می باشد به عبارت دیگر هنگامی که (AB) در موقعیت اکتاهدرال قرار دارد نیمی دیگر از یون های B در موقعیت تتراهدرال هستند.
شکل ۲: شماتیک ساختار کریستالی اسپینل معکوس NiFe۲O۴
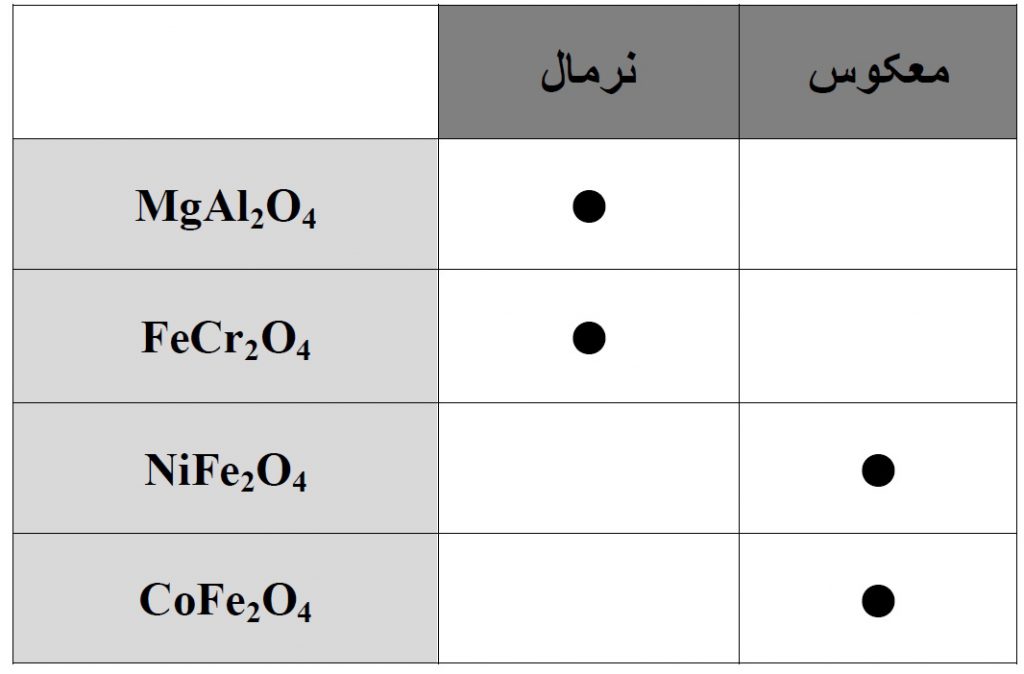
برخی از ترکیبات اسپینل نرمال و معکوس به شرح زیر است :
مغناطش در اسپینل ها
اسپینل ها بسته به ساختار و ماهیت یون های فلزی می توانند فرو یا آنتی فرو مغناطیس باشند. در واقع از طریق یون های اکسید، کوپلاژ ممان ها اتفاق می افتد.
در اسپینل ها، ممان های موقعیت های تتراهدرال در یک جهت هستند در صورتی که برای موقعیت اکتاهدرال جهت ممان ها عکس می باشد. در صورتی که تعداد ممان های این دو موقعیت اتمی برابر باشد ماده یک اسپینل آنتی فرومغناطیس خواهد بود و در غیر این صورت فرومغناطیس می باشد.
به عنوان مثال، در اسپینل های معکوس مثل NiFe۲O۴ و Fe۳O۴ خاصیت فرومغناطیسی مشاهده می شود. در این حالت ممان های یون های سه ظرفیتی خنثی می شود زیرا نیمی از آن ها در موقعیت اکتاهدرال و نیمی دیگر در موقعیت تتراهدرال هستند. اما در کنار این ها ممان های یون های دو ظرفیتی نیز وجود دارد که عامل اصلی خاصیت مغناطیسی در این مواد است.
در اسپینل های نرمال، مثل FeCr۲O۴ تعداد ممان های ناشی از یون های Fe و Cr با یکدیگر برابر است، لذا ماده مذکور آنتی فرومغناطیس خواهد بود. اما اسپینل نرمال MgAl۲O۴ یک ماده دیا مغناطیس است،زیرا تمام الکترون های موجود در یون های فلزی جفت شده اند.
شکل ۳: کوپلاژ ممان های مغناطیسی در اسپینل ها.
کاربردهای مواد اسپینلی
با توجه به گستردگی مواد با ساختار اسپینلی، تفاوت در نوع یون های کاتیون و آنیون و همچنی ناخالصی های موجود به دلیل تفاوت در ویژگی ها، کاربردهای مختلفی هم دارا می باشند.از جمله کاربرد اسپینل ها می توان به موارد زیر اشاره کرد:
• پوشش های مقاوم در برابر حرارت در صنایع نسوز
• کاربردهای مقاوم در برابر شعه نوترون
• حسگر های رطوبت
• کاتالیست ها
همچنین در سال های اخیر در حوزه پزشکی و بایو مواد نیزاسپینل ها بسیار مورد توجه و مطالعه قرار گرفته اند و در واقع به عنوان یک سرامیک پیشرفته مهندسی (سرامیک های اکسیدی ) کارایی پیدا کرده است.
منابع
[۱] “Zirconia in Dentistry”, https://www.ddslab.com/zirconia-in-dentistry/, 2020.
[۲] K. Shanmugam & R. Sahadevan, “Bioceramics: An Introductory Overview”, Fundamental Biomaterials: Ceramics, pp. 1-46, 2018.
[۳] A.D. Bonna, “Zirconia as a Dental Biomaterial”, Materials MDPI, pp. 4978–۹۱, ۲۰۱۵.
[۴] “Zirconia (ZrO۲ or Zirconium Oxide)”, https://www.ceramcoceramics.com/materials/zirconia/zirconia.php.
[۵] “Making Zirconia by Zirconium Chlorination”, https://www.911metallurgist.com/making-zirconia.
[۶] www.substech.com/dokuwiki/doku.php?id=bayer_process
[۷] feeco.com/alumina-processes-and-uses/
[۸] A. M. Abyzov,” Aluminum Oxide and Alumina Ceramics (review). Part 1. Properties of Al۲O۳ and Commercial Production of Dispersed Al۲O۳”, Refract Ind Ceram, Vol.60, pp.24–۳۲, ۲۰۱۹.
[۹] https://chem.libretexts.org/Bookshelves/Inorganic_Chemistry/Book%3A_Introduction_to_Inorganic_Chemistry/08%3A_Ionic_and_Covalent_Solids_Structures
[۱۰] /۸.۰۷%۳A_Spinel%2C_Perovskite%2C_and_Rutile_Structures
https://www.adichemistry.com/inorganic/cochem/spinels/spinel-structures.html
[۱۱] Kurt E. Sickafus,” Spinel Coumpounds: Structure and Property Relations”, J. Am. Ceram. Soc., Vol.82, pp.3279–۹۲ ,۱۹۹۹.
[۱۲] I. Ganesh,” A review on magnesium aluminate (MgAl2O4) spinel: synthesis, processing and applications”, International Materials Reviews, 2013.