کاربید سیلیسیم (سیلسیم کارباید) (SiC) نقطه ذوب بالا، سختی بالا، دانسیته پایین، مقاومت به سایش عالی، مقاومت به خوردگی بالا، مدول الاستیک بالا و ضریب انبساط حرارتی پایین دارد.
مقدمه
سرامیک های کاربیدی با پیوند کووالانسی به عنوان مهمترین رده از سرامیک های دیرگداز برای کاربردهای مختلف در دمای محیط و در دماهای بالا شناخته می شوند.
یکی از این سرامیکها کاربید سیلیسیوم (سیلسیم کارباید) (SiC) است که دارای خواص منحصربه فردی از جمله نقطه ذوب بالا، سختی بالا، دانسیته پایین، مقاومت به سایش عالی، مقاومت به خوردگی بالا، مدول الاستیک بالا، ضریب انبساط حرارتی پایین و خواص نیمه هادی می باشند.
ترکیب این خواص در کنار هم باعث کاربردهای ویژه sic در صنابع مربوط به فضا و انرژی، توربین های گازی، مبدل های حرارتی شده است. هم چنین به عنوان ساختاری سازنده برای راکتورهای هسته ای در آینده به علت فعالیت کم آنها تحت تابش نوترون شناخته می شود. علیرغم خواص قابل توجه این سرامیکها، کاربرد آن به علت سینترپذیری پایین و لزوم اعمال دما یا فشارهای بالا در سینترینگ، دچار محدودیت شده است.
عدم امکان سینتر کاربیدهای کووالانسی به ویژه کاربیدسیلیسیم به علت نقطه ذوب بالا، ضریب دیفوزیون در خود پایین ناشی از پیوند قوی کووالانسی میباشد. علاوه براین تافنس شکست نسبتاً پایین یکی دیگر از معضلات مهم و محدود کننده این سرامیک است. ارائه راه حلهایی برای این مشکل به همراه بهبود و یا حفظ خواص مطلوب این سرامیک کاربیدی بسیار مورد توجه می باشد.
تاریخچه کاربید سیلیسیم
کاربید سیلیسیم به طور اتفاقی در سال ۱۸۹۰ میلادی به وسیله ادوارد.ج.اچسون کشف شد وی دستیار توماس ادیسون بود و هنگام انجام آزمایشی برای سنتز الماس این ماده را کشف کرد. اچسون گمان کرد ماده جدید ترکیبی از کرین و آلومیناست که در رس وجود دارد و نام آن را کربوراندوم گذاشت، نامی که هنوز در بعضی موارد استفاده می شود. کاربید سیلیسیم به طور طبیعی در شهاب سنگها به وجود می آید، البته به ندرت و در مقادیر بسیار اندک. اچسون اولین کسی بود که با عبور دادن یک جریان الکتریکی از مخلوط رس و کربن، کاربید سیلیسیم را سنتز کرد. امروزه کاربید سیلیسیم هنوز از طریق یک واکنش حالت جامد بین ماسه (دی اکسید سیلیسیم) و کک نفتی (کربن) در دماهای بسیار بالا در کوره قوس الکتریکی تولید می شود.
درگذشته فهرست سرامیک هایی که به عنوان مواد صنعتی به کار میرفتند شامل آلومینا و دیگر اکسیدها بود. در سال های اخیر تمایل زیادی برای استفاده از سرامیک ها به عنوان مواد ساختاری به جای فلزات و آلیاژها و برای استفاده در محیط های ناملایم به وجود آمده است. در نتیجه سرامیک های جدید مانند نیتریدها، کاربیدها و دیگر ترکیبات کووالانسی توجه زیادی را به علت ویژگیهای واحدشان جذب کرده اند.
کاربید سیلیسیم یکی از معدود سرامیکهایی است که پیوند کووالانسی دارد و سبک است. چگالی تئوری کاربید سیلیسیم β تنها ۳.۲۱۰ گرم بر سانتیمترمکعب و کاربید سیلیسیم α برابر ۳.۲۰۸ گرم بر سانتیمتر مکعب است. ترکیب وزن سبک و پیوند کووالانسی قوی با دیگر خواص مانند ضریب انبساط حرارتی پایین و هدایت حرارتی، برای استحکام و سختی بالا کاربید سیلیسیم را به سرامیکی مناسب برای جایگزینی فلزات، و آلیاژها و سرامیکهای اکسیدی با پیوند یونی رایج تبدیل کرده است[۱].
ساختار کریستالی کاربید سیلیسیم
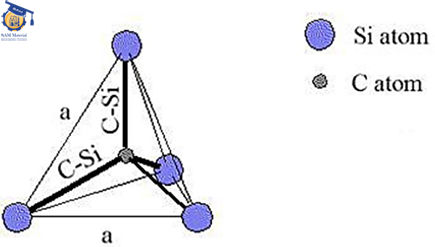
کاربید سیلیسیم ماده ای نسبتاً ساده است، زیرا خواص و ساختار آن اساساً ایزوتروپ است. در سلول واحد آن هر اتم از یک عنصر با چهار اتم از عنصر دیگر احاطه شده است و یک چهاروجهی تشکیل میدهد (شکل ۱). هر عنصر جفت الکترونهایش را با دیگری به اشتراک گذاشته است ( چهار اوربیتال ۲SP۳ کربن با چهار اوربیتال ۳SP۳ سیلیسیم).
کاربید سیلیسیم
شکل ۱: پیوندهای اتم با چهار سیلیسیم مجاور و تشکیل چهاروجهی.[۲]
هر سلول واحد SiC شامل هشت اتم است که در موقعیتهای زیر قرار گرفته است.
سیلیسیم ۸* ۱.۸ اتم در گوشهها ، سیلیسیم ۶ * ۱.۲ اتم در سطوح و کربن ۴ اتم در داخل مکعب در موقعیت چهاروجهی.[۲]
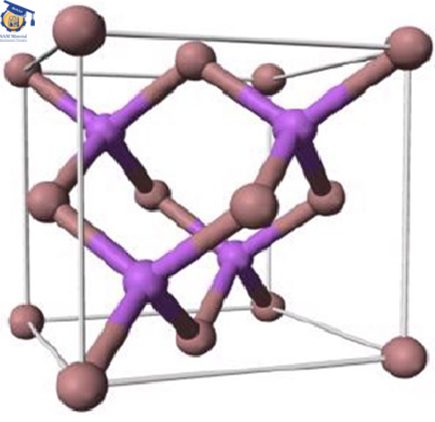
سلول واحد کاربید سیلیسیم
شکل۲: تصویر شماتیک از سلول واحد SiC (اتم سیلیسیم در گوشهها و اتم کربن در داخل مکعب) .[۲]
کاربید سیلیسیم در دو شکل بلوری مختلف وجود دارد، یکی کاربید سیلیسیم مکعبی به نام کاربید سیلیسیم β و دیگری یک سری از شکل های هگزاگونال- رمبوهدرال به نام کاربید سیلیسیم α. همه این گونه ها دارای چهارچوب هگزاگونال بوده که اتم کربن دربین مثلث ایجاد شده از اتم های سیلیسیم از لایه پایینی و یک اتم سیلیسیم از لایه بالایی قرار گرفته است (شکل ۲).
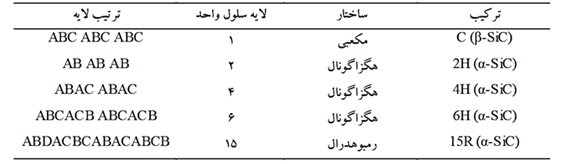
اختلاف بین این گونه ها در ترتیب چیدن و توالی جفت لایه های اتمهای کربن و سیلیسیم می باشد. در شکل ۳ توالی چیده شدن در چندگونه متداول ارائه شده است. در صورتیکه جفت لایه اول موقعیت A نامیده شود، لایه بعدی بر اساس ساختار فشرده می تواند در موقعیت B یا C قرار گیرد. انواع گونه ها براساس توالی این لایه ها بدست می آید. بطور مثال گونه ۲H توالی چیدن آن بصورت AB AB… است که در این حالت ساختار حاصله هگزاگونال است. نوع ۳C تنها گونه مکعبی می باشد و توالی آن بصورت ABC ABC… یا ACB ACB… است[۳].
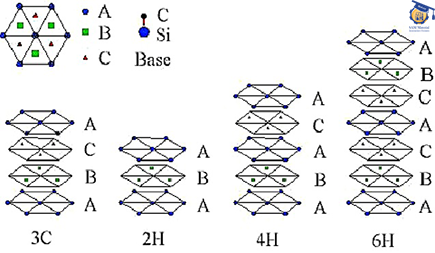
سیلسیم کارباید
شکل ۳: توالی چیدن جفت لایه های چند گونه متداول SiC .
کاربید سیلیسیم مکعبی (β-SiC) تنها در دمای کمتر از ۲۱۰۰ درجه سلسیوس پایدار است ساختار آن FCC و شبیه به ساختار سولفور روی (ZnS) است. ساختار مکعبی کاربیدسیلیسیم منحصر به فرد است. شکل لایههای صفحه {۱۱۱} ABC ABC است که به مفهوم مشابه بودن هر سه لایه می باشد. این ساختار مشابه با ساختار الماس و همچنین نیتریدبور مکعبی است.
کاربیدسیلیسیم نوع آلفا در دماهای بالاتر از ۲۱۰۰ درجه سانتیگراد فاز غالب می باشد. بر خلاف کاربید سیلیسیم بتا که تنها دارای یک گونه است کاربیدسیلیسیم آلفا دارای گونه های متفاوت است. این گونه های مختلف دارای ساختار هگزاگونال و یا رمبوهدرال هستند. این گونه ها اساساً دارای ثوابت شبکه یکسان در دو بعد و متفاوت در بعد سوم هستند که چندین گونه متداول آنها در شکل ۳ و جدول ۱ ارائه شده است[۳],[۴].
جدول ۱: انواع گونه های متداول SiC
سیستم Si-C
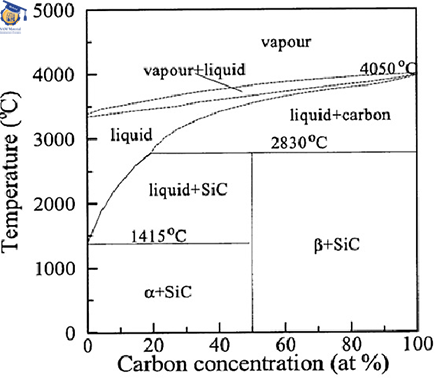
تشکیل کاربیدسیلیسیم از واکنش سیلیسیم و کربن دردماهایی کمتر از دمای ذوب سیلیسیم امکان پذیر است. دیاگرام فازی سیستم سیلیسیم-کربن در شکل ۴ نشان داده شده است. مشاهده میشود که کاربیدسیلیسیم تنها ترکیب سیلیسیم و کربن است که در حالت جامد در کنار عناصر سیلیسیم و کربن ایجاد میشود. یک نقطه یوتکتیک بین سیلیسیم و کاربید سیلیسیم درد دمای ۱۴۰۲ درجه سلسیوس و ۰.۷۵ درصد اتمی کربن وجود دارد.
منحنی لیکوئیدوس بین سیلیسیم و کاربیدسیلیسیم تا ۲۶۰۰ درجه سلسیوس و ۲۷ درصد اتمی کربن دیده میشود. یک نقطه پری تکتیک نیز در دمای ۲۵۴۰ درجه سلسیوس و ۲۷ درصد اتمی کربن زیر شرایط نرمال قرار دارد[۵].
شکل ۴: دیاگرام فازی سیلیسیم-کربن[۵].
خواص فیزیکی کاربید سیلیسیم
چگالی کاربید سیلیسیم
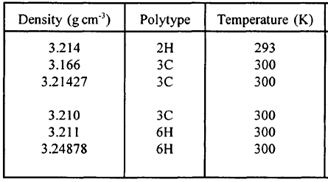
محاسبات آزمایشگاهی نشان می دهد چگالی SiC بسته به پلی تایپ های مختلف در محدوده ۳.۱۶۶ تا ۳.۲۴۸گرم بر سانتیمترمکعب است. اغلب اندازه گیری ها بر اساس داده های آنالیز XRD وفرمول زیر بدست آمده است:
d = 4M/NV
که M جرم وزنی(۴۰.۰۹۷)، V حجم واحد سلول، N عدد آوواگادرو است.
در جدول۱ چگالی پلی تایپ های مختلف سیلیسیم کارباید ذکر شده است[۶].
جدول۱: چگالی SiC در دماهای مختلف[۶].
هدایت حرارتی کاربید سیلیسیم
هدایت حرارتی (k) نرخ جریان حرارت درون یک ماده است و معمولا در واحدهای SI یعنیW/m.°K است. میزان انتقال حرارت با میزان انرژی حرارتی موجود و میزان اتلاف کنترل می شود.
به علت هدایت حرارتی بالا، کاربید سیلیسیم یک ماده بسیار جذاب برای کاربردهای دما بالاست. از منظر هدایت حرارتی کاربید سیلیسیم از مس، اکسید برلیم، آلومینا و نیترید آلومینیوم بالاتر است. هدایت حرارتی تک کریستال کاربید سیلیسیم W/m.°K500 گزارش شده است. البته اغلب رده های کاربید سیلیسیم تجاری هدایت حرارتی در محدوده W/m.°K برابر ۵۰ تا ۱۲۰ دارد[۷].
مراجع
[۱]: فرجی پور قهرود، ع، اثر میزان نانو ذرات کاربید سیلیسیم بر خواص مکانیکی نانو کامپوزیت آلومینا -کاربید سیلیسیم، پژوهشگاه مواد و انرژی، ۱۳۹۳
[۲]: Smith, T. P., Silicon carbide, Encyclopedia of Materiales: Science and Technology (second edition), Vol., pp. 1-6, 2001.
[۳]: Izhevskyi, V. A., Genova, L. A. and Bressiani, J. C., “Review article: Silicon carbide. Structure, Properties and processing” Ceramica, Vol., pp. ۱۲۶-۱۵۴, ۲۰۰۰.
[۴]: Catellani, A.and Galli, G., “Theoritical studies of silicon carbide surfaces”, Progress in Surface Science, Vol. 69, pp. 101-124, 2002.
[۵]: عبادزاده، ت.، کاربیدها: ،دانش پویان جوان، تهران، ۱۳۸۵
[۶]: Haris,G., Propertise of Silicon Carbide, Institution of Electrical Engineers,London, United Kingdom,1995.
[۷]: Rashed, A.H., Properties and Characteristics of Silicon Carbide, 2002.